Yavaş yavaş ortaya çıkan unutkanlıklarla kendini göstermeye başlayan Alzheimer hastalığı genel olarak 3 evreye ayrılıyor. Birinci evrede, isimleri, olayları, tarihleri, eşyaların yerini unutma, kelimeleri bulamama ve yanlış kullanma, soruları tekrarlama, işine, çevresine ve hobilerine karşı ilgi yitirme gibi belirtiler görülüyor ve kişi genellikle hasta olduğunu kabul etmek istemiyor. İkinci evrede, bellek kaybı belirginleşiyor; yeni hiçbir şey öğrenememe, yakınlarının isimlerini unutma, yolunu kaybetme, yıkanma, giyinme gibi günlük işlerde yardıma ihtiyaç duyma, hayal görme, depresyon, uyku bozukluğu, çabuk sinirlenme gibi ruhsal ve davranışsal değişiklikler görülüyor. Üçüncü evredeyse, hasta, ailesini bile tanıyamazken, yatağa bağlı ve tamamen bakıma muhtaç duruma geliyor.
Alzheimer hastalığıyla ilgili en net bilgi, yaşın çok önemli risk faktörü olduğu. Sayıları görece az olan olgularda, kalıtımın da rol oynadığı görülüyor. Yani, Alzheimer mutasyonlarını taşıyan genlerden biri aileden miras alındıysa, hastalık er geç kişiyi yakalıyor. Kalıtsal olgular, diğerlerine oranla oldukça erken yaşta beliriyor. Ancak, olguların büyük çoğunluğunda, bu türden net bir genetik miras gözükmediği gibi, genelde yaş dışında bilinen bir risk faktörü de olmuyor. Yine de, her iki türde de, beyin patolojisi ve bilişsel zararlar aynı oluyor ve ortak bir moleküler mekanizma işliyor.
Alzheimer hastalığında yaşın neden bu kadar önemli bir risk faktörü olduğuyla ilgili olarak, bu güne kadar, yalnızca birkaç spekülasyon yapılmış. Bu modellerden birinde, yaşın ilerlemesiyle azalma gösteren en önemli enerji molekülü olan adenozin trifosfat'ın (ATP), bu durumdan sorumlu olduğu öne sürülüyor. Çünkü, yaşlanan beyinde nöronal ATP azalıyor ve nöronlar (sinir hücreleri) dinlenme anında bile ATP'ye pek çok hücreden daha fazla gereksinim duyuyorlar. ATP olmadan hücreler dengelerini yeniden kurmada zorlanabiliyor ve Alzheimer peptidinin nörotoksik etkilerine karşı kendilerini koruyamıyorlar.
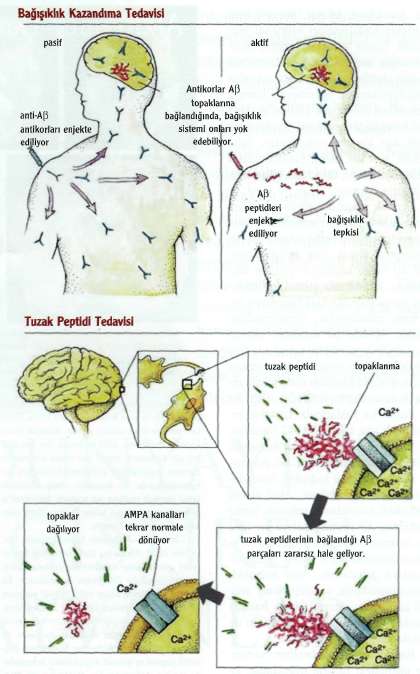
Hastalığın nasıl tedavi edileceğine yönelik sorunun cevabınaysa oldukça yaklaşıldı ama hâlâ tam olarak erişile-medi. Depresyon, endişe, huzursuzluk, halusinasyon (sanrı) ve uyku bozukluğu gibi hastalığın ikincil belirtilerini hafifletmek için tedavi seçenekleri bulunuyor. Hafıza kaybı, zihin karışıklığı, kişilik değişmeleri gibi belirtiler için de, yalnızca kısmi ve kısa zamanlı rahatlatma sağlasalar da, az sayıda onaylanmış tedavi var. Alzheimer'ın asıl nedeni için bir ilaç ya da tedavi yöntemine ulaşmak şimdilik hayli zor görünüyor. Yine de, hastalığın temeli anlaşıldıkça, birkaç umut verici ilaç tedavisi ufukta gözükmeye başladı. Hatta birkaç aday, klinik denemelere girdi bile. Farklı stratejiler izleyen bu bileşiklerin hepsi, hücrelerin anormal işlevinin ve ölümü-
nün habercisi olan moleküler olayları durdurmayı ya da tersine çevirmeyi amaçlıyorlar.
Alzheimer Nedir?
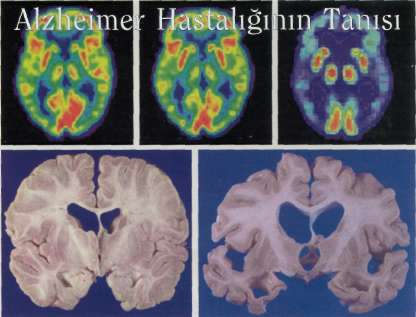
Alzheimer hastalığı, yaklaşık 100 yıl kadar önce nörolog Alois Alzheimer tarafından tanımlanmıştı. Alzheimer, 51 yaşındaki bir hastasına yaptığı otopside, normalde oldukça yaşlı insanlarda bulunan çok sayıda senil plağı ve nöronların içinde, birbirine dolaşmış kıvrık protein parçalarından oluşan yığınlar belirledi. Alzheimer, bu yeni topaklı yapılarla birlikte, hastanın yaşı ve alışılmadık sayıdaki senil plaklarına dayanarak, bu hastalığın, normalde yaşlılarda görülebilecek zihinsel işlev ve duygusal denge azalmasından farklı bir durum olduğuna karar verdi. Alzheimer, beyin anatomisindeki karakteristik değişikliklerin çoğunun kortekste meydana geldiğini de belirtmişti. Hâlâ tümüyle anlaşılmamış nedenlerden dolayı, ön korteks gibi bazı beyin bölgeleri, Alzheimer hastalığından çok daha fazla etkileniyor. Bu bölgesel hasar da, belli beyin işlevlerinde azalmaya yol açıyor.
Neden ne olursa olsun, aynı moleküler patoloji karşımıza çıkıyor: Normal bir proteinin yanlış katlanan parçalarının, bir kitle halinde topaklanması. Bu normal protein, yani amiloid prekürsör proteini (APP) çeşitli dokularda hücrelerin dış zarında bulunuyor. APP alfa, beta ve gama sekretaz enzimlerince, üç
BİLİMvcTEKNİK
60 Eylül 2003