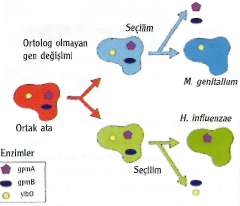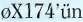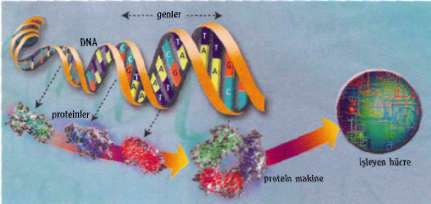
İnsanoğlunun yüzyıllardır cevap aradığı "Yaşam nedir?" sorusu bir süre daha kafamızı meşgul edecek gibi görünüyor. Ancak cevaba hiç bu kadar yakın olmamıştık. Bilim adamları artık bu soruya doğrudan bir yanıt bulmaya çalışıyor. Nasıl mı? Bir tane daha yaparak!
Ünlü bilim adamı Craig Venter, 2003 yılı Kasım ayında yaklaşık beş bin baz uzunluğunda bir virüs genomunu yapı taşlarından iki hafta gibi rekor bir sürede sentezlemeyi başardı. Bakteri hücrelerine aşılanan virüs DNA'sının tamamen işlevsel olduğu, tıpkı doğalı gibi virüs proteinleriyle kaplı yeni genomların başka virüsler içine girerek kendilerini kopyalayabildiği gözlendi. Projeyi destekleyen ABD Enerji Bakanlığı yetkilisiyle birlikte başarısını ilan eden Venter yeni hedefinin yaklaşık üç yüz bin baz uzunluğunda bir bakteri genomu sen-tezlemek olduğunu açıkladı. Yaşam için gerekli asgari genetik bilgiyi taşıyacak olan bu kromozomun, DNA'sı çıkarılmış bir bakteriye nakliyle, ilk yapay yaşam yaratılmış olacak. Hem Venter hem de ABD Enerji Bakanlığı, henüz doğmamış bu yapay bakteriyle ilgili büyük umutlar taşıyorlar.
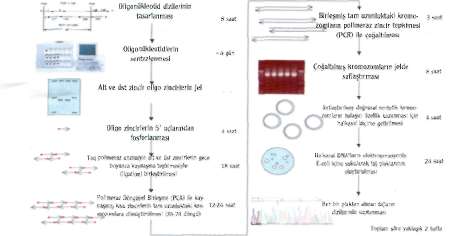
Venter'in geliştirdiği yeni yöntem, 5-6 bin baz uzunluğundaki DNA parçalarının, sentetik oligonükleotitler-den kalıp kullanılmadan sentezlenmesi için gerekli zamanı önemli ölçüde kısaltıyor. Bakteri virüsü 0X174'ün 5386 baz uzunluğundaki genomunun kimyasal olarak sentezlenmesi yalnızca 14 gün sürdü. Bir önceki yıl yapı
BİLİM ve TEKNİK 38 Nisan 2004
taşlarından sentezlenen ilk virüs olan çocuk felci virüsünün 7440 baz uzunluğundaki genomunun tamamlanmasının üç yıl sürdüğü düşünüldüğünde, Venter'in başarısının büyüklüğü kolayca anlaşılıyor. Yeni virüs parçacıkları oluşturma yeteneğine sahip genom, doğal virüsler kadar olmasa da işlevsel. 0X174'ün genomu oldukça sıkı bir genetik örgütlenme gösteriyor: İki farklı okuma çerçevesi üzerin-
den okunan genler bazı bölgelerde üst üste çakışıyor. Bu durum işlevsel bir genom elde etmek için oldukça hatasız bir baz diziliminin sağlanmasını zorunlu kılıyor. Venter'in tekniğinde, ortalama her beş yüz bazda bir baz yanlış yerleşiyor. Bu hata oranına rağmen sentezlenen DNA zincirlerinden tamamen hatasız olanlar da belirlenmiş. Daha kusursuz DNA zincirleri elde etmek için yanlış yerleşmeleri dü-